Eindeutige Kennzeichnung von Medizinprodukten im Lichte der neuen Gesetzgebung.
Eindeutige Kennzeichnung von Medizinprodukten im Lichte der neuen Gesetzgebung.
Was erwartet uns also in naher Zukunft?
Wir haben das Thema der eindeutigen Kennzeichnung von Medizinprodukten bereits in unserem Blog behandelt. Heute möchten wir Sie mit dem Thema der Änderungen an den bestehenden Verordnungen vertraut machen.
UDI-Verordnungen wurden von der US-amerikanischen Food and Drug Administration, der Europäischen Kommission und globalen Regulierungsbehörden entwickelt und umgesetzt. Ihr Hauptziel ist es, die Patientensicherheit zu erhöhen und die Qualität der Gesundheitsversorgung zu verbessern.
Ursprünglichen Annahmen zufolge sollte die Pflicht zur Angabe von Codes auf medizinischen Etiketten und Verpackungen frühestens ab dem 26. Mai 2021 (Klasse III) in Kraft treten. Das Einführungsdatum variierte in Abhängigkeit von den verschiedenen Klassen der Produkte selbst.
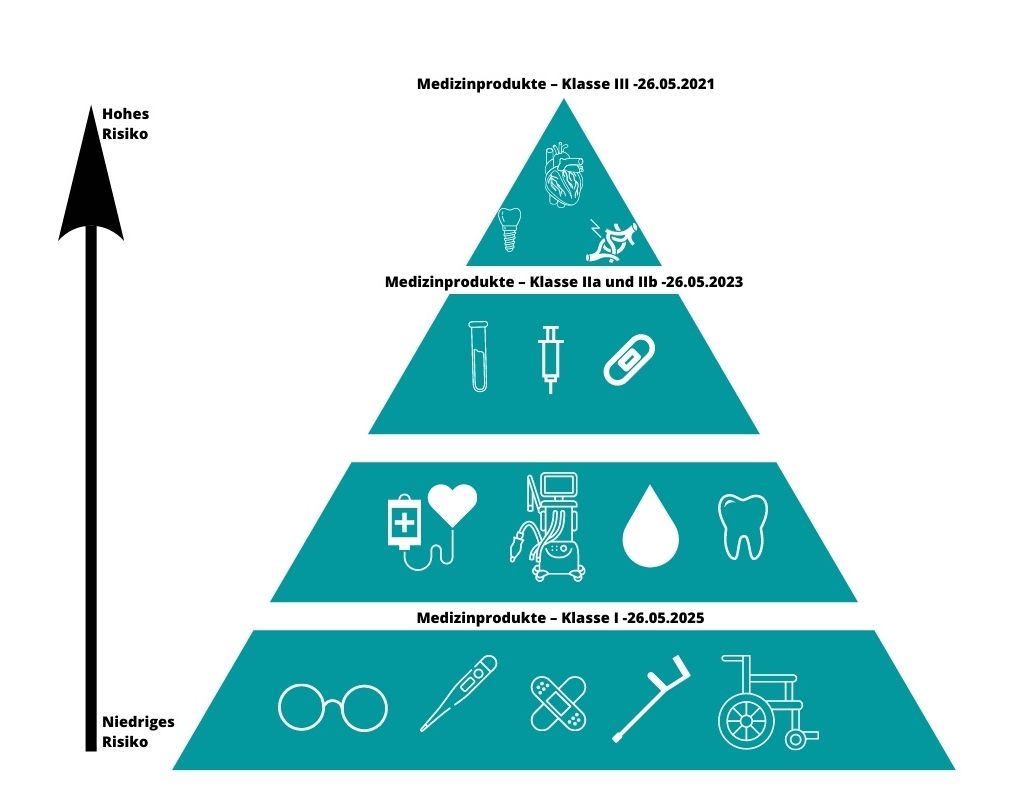
Eigene Ausarbeitung auf der Grundlage von https://gs1pl.org/
Am 6. Januar 2023 verabschiedete die Europäische Kommission -Änderungsvorschläge zu MDR (Medical Devices Regulation) zur Verlängerung der Übergangsfristen für Medizinprodukte. Dies ist eine äußerst wichtige Nachricht für die Hersteller von Medizinprodukten, die seit Monaten befürchten, keine Zeit mehr zu haben, um die MDR-konformen Verfahren und Zertifizierungen durchzuführen.
Für implantierbare Produkte der Klassen III und IIb gelten verlängerte Übergangsfristen bis zum 31.12.2027, für Produkte der Klassen IIb und IIa sowie für Produkte der Klasse I mit Messfunktion oder steril bis zum 31.12.2028. Alle Produkte der Klasse I nach MDD (Medical Device Directive), die nach der MDR in eine höhere Klasse eingestuft werden sollten, dürfen unter bestimmten Voraussetzungen bis zum 31.12.2028 in Verkehr gebracht werden. Die verlängerten Fristen gelten nur für Hersteller, die bis spätestens 26.05.2024 einen förmlichen Antrag auf Zertifizierung bei der notifizierenden Stelle stellen. Ein wichtiges Element der Änderungen ist auch die Aufhebung der Sell-Off-Klausel, was bedeutet, dass Produkte, die vor dem 26.05.2021 in Verkehr gebracht wurden, länger als bis Mai 2025 auf dem Markt bleiben.
Prespack bietet spezielle Dienstleistungen für die pharmazeutische Industrie an. Wir arbeiten täglich sowohl mit Herstellern von Arzneimitteln als auch mit Produzenten von Medizinprodukten zusammen. Wir führen Vertragsverpackungen und Umverpackungen sowie deren Serialisierung und Aggregation durch. Wir sind bestrebt, unsere Kunden zu unterstützen und teilen daher gerne unser Wissen über Änderungen und Anpassungen der Vorschriften.










